Это короткий фрагмент для ознакомления с книгой.
Георгий Борисович Шульпин Эта увлекательная химия
 Аппаратура, изображения в одной из таблиц 'Курса химии' Николя Лемери (Париж, 1756 г.)
Аппаратура, изображения в одной из таблиц 'Курса химии' Николя Лемери (Париж, 1756 г.)
 Рисунок из 'Курса аналитической и физиологической химии' Робэна и Bердейля (Париж, 1853 г.). Так выглядят под микроскопом кристаллы некоторых веществ животного происхождения
Рисунок из 'Курса аналитической и физиологической химии' Робэна и Bердейля (Париж, 1853 г.). Так выглядят под микроскопом кристаллы некоторых веществ животного происхождения
 На рисунке 'Пликто' Джовани Вентуры Россети (Венеция, 1548 г.) изображена одна из стадий работы по крашению ткани
На рисунке 'Пликто' Джовани Вентуры Россети (Венеция, 1548 г.) изображена одна из стадий работы по крашению ткани
Предисловие
Эта книжка — об органической химии. История этой науки полна гениальных "догадок, блестящих, исключительных по своему изяществу и наглядности экспериментов, острых столкновений идей и гипотез, обширных, революционизирующих всю нашу жизнь приложений в сфере техники, медицины, сельского хозяйства, быта. По сравнению с некоторыми другими областями знания органическая химия — наука молодая. Действительно: математика и астрономия зародились в глубокой древности, тысячелетия назад; возраст физики (точнее, некоторых ее разделов, например, механики) исчисляется многими сотнями лет. Органическая химия сформировалась как особая область химической науки, приобрела необходимый всякой науке теоретический фундамент и перешла от собирания фактов к их осмыслению немногим более столетия назад. Но сколько сделано за этот короткий срок! Получены миллионы новых соединений, среди них лекарства и красители, душистые вещества и волокна, топливо и пластмассы, продукты питания и биологически активные вещества, открыты сотни типов химических реакций. И хотя фундамент органической химии в настоящее время представляется в основном завершенным, наука эта продолжает интенсивно развиваться и дарить радостью открытий и находок все новые поколения исследователей. В первых главах автор рассказывает о самых основных понятиях органической химии, о простейших классах органических веществ. Затем автор переходит к приложениям органической химии в других областях знаний, прежде всего — в биоорганической химии и молекулярной биологии. Эти ветви естествознания, сформировавшиеся в последние несколько десятилетий, целиком заимствуют из органической химии ее закономерности, теоретический аппарат. Многие стороны биологических процессов, ранее казавшиеся таинственными и непознаваемыми, удалось перевести на ясный, четкий язык химических формул. Для кого эта книжка? Прежде всего, она адресована нашей молодежи, школьникам, которым предстоит выбор профессии. Кое-что интересное найдут здесь для себя и другие читатели, все, кто интересуется химией. Люди, наукой профессионально не занимающиеся, обычно довольно слабо представляют себе, в чем заключается обыденный труд научного работника. Многие не знают, каким образом специалисты обмениваются информацией, не подозревают о существовании огромного количества научных узкоспециальных журналов. Бывает, что, не найдя ответа на какой-либо вопрос в учебниках или научно-популярных изданиях, приходят к выводу, что этот вопрос наукой вообще не затрагивался. Автор попытался в последних главах в какой-то мере осветить эту сторону жизни науки, рассказать, как пользуются реферативными журналами, приоткрыть дверь в научную библиотеку. Не оставил он без внимания и другую очень важную сторону работы современного химика-органика — использование достижений физики и техники. Эти разделы дают некоторое представление о том, как тесно связаны, переплетены современные науки. Автор этой книги Г. Б. Шульпин, кандидат химических наук, работает в Институте химической физики Академии наук СССР. Он выпускник химического факультета МГУ, принадлежит к младшему поколению исследователей школы академика А. Н. Несмеянова. В настоящее время Г. Б. Шульпин занимается исследованием механизмов металлокомплексного гомогенного катализа и синтезом металлоорганических соединений. Уже много лет он совмещает исследовательскую работу с популяризацией науки, известен своими публикациями в журналах "Наука и жизнь", "Химия и жизнь". Думаю, что читателям будет интересно ознакомиться с органической химией "из первых рук", в изложении исследователя-экспериментатора, который активно работает в одном из актуальных направлений этой науки, и, как мне представляется, сумел передать в этой небольшой по объему книге дух увлеченности и восхищения исследователя совершеннейшим созданием человеческого ума, имя которому — химия. М. ГольдфельдГлава 1. Метан, этилен, ацетилен
 Сколько самых разных зданий — больших и маленьких, прекрасных и неказистых — выстроено на земле. Что общего может быть у собора Василия Блаженного и вот этого старого, предназначенного на слом домишки, закрывающего вид из вашего окна? А общее вот что: они построены, в принципе, из однотипных деталей. Так же, как в архитектуре, в химии громадное разнообразие сложнейших органических соединений сводится всего к нескольким видам простых "кирпичиков", из которых "складываются" молекулы всех этих веществ.
Сколько самых разных зданий — больших и маленьких, прекрасных и неказистых — выстроено на земле. Что общего может быть у собора Василия Блаженного и вот этого старого, предназначенного на слом домишки, закрывающего вид из вашего окна? А общее вот что: они построены, в принципе, из однотипных деталей. Так же, как в архитектуре, в химии громадное разнообразие сложнейших органических соединений сводится всего к нескольким видам простых "кирпичиков", из которых "складываются" молекулы всех этих веществ.
Простая связь
Самое простое органическое соединение — метан. Его молекула состоит из пяти атомов — одного атома углерода и четырех атомов водорода, равномерно распределенных в пространстве вокруг этого центрального атома углерода. Здесь мы сталкиваемся прежде всего с важнейшим постулатом органической химии — во всех незаряженных органических молекулах углерод всегда четырехвалентен. Графически это выражается в том, что он должен быть соединен с химическими символами других элементов или того же углерода четырьмя черточками. В метане все четыре атома водорода находятся на одинаковом расстоянии от атома углерода и максимально удалены друг от друга в пространстве. В молекуле метана атом углерода находится в центре правильного тетраэдра, а четыре атома водорода — по его вершинам.
Так выглядит молекула метана с учетом размеров атомов.
Чтобы построить модель молекулы, возьмем тетраэдр, т. е. правильный четырехгранник, составленный из равносторонних треугольников, и поместим в его центр атом углерода. Атомы водорода расположатся по вершинам тетраэдра. Соединим все водороды с центральным атомом углерода. Угол α между двумя такими линиями составит 109 градусов и 28 минут.
Итак, мы построили модель метана. Но каковы размеры молекул в действительности? В последние десятилетия при помощи физических методов исследования (о них речь впереди) удается точно определить межатомные расстояния в молекулах органических соединений. В молекуле метана расстояние между центрами атома углерода и любого водородного атома равно 0,109 нм (1 нанометр, нм, равен 10-9 м). Чтобы представить наглядно, как выглядит молекула в пространстве, пользуются моделями Стюарта — Бриглеба, в которых атомы изображаются шариками определенного радиуса.
Теперь зададимся таким вопросом: какие силы связывают атомы в молекуле органического соединения, почему атомы водорода не отрываются от углеродного центра?
Атом углерода состоит из положительно заряженного ядра (его заряд равен +6) и шести электронов, занимающих различные орбитали[1] вокруг ядра, каждой из которых соответствует определенный уровень энергии.
Два электрона занимают самую нижнюю, ближайшую к ядру орбиталь. Они всего сильнее взаимодействуют со "своим" ядром и участия в образовании химических связей не принимают. Иное дело — остальные четыре электрона. Считают, что в так называемом невозбужденном атоме углерода, т. е. в отдельном атоме, не образующем никаких связей с другими атомами, эти электроны располагаются следующим образом: два на нижнем подуровне s и два на более высоком подуровне р. Несколько упрощенно и схематично можно считать, что облако, которое образует электрон, находящийся на s-подуровне, имеет форму сферы. Облака р-электронов выглядят объемными восьмерками, причем эти восьмерки могут быть расположены в пространстве вдоль осей х, y и z. В соответствии с этим в каждом атоме имеются три р-орбитали: px, рy и pz. Итак, каждая орбиталь в атоме имеет определенную форму и особым образом расположена в пространстве.
Для того чтобы вступить во взаимодействие с другими атомами, образовать с ними химические связи, атом углерода должен прежде всего перейти в особое, возбужденное состояние. При этом один электрон перескакивает с s-орбитали на p-орбиталь. В результате один электрон занимает сферическую s-орбиталь, а три остальных электрона образуют три орбитали-восьмерки. Однако такое положение атому энергетически невыгодно. Более низкой энергии атома соответствуют четыре одинаковые орбитали, симметрично расположенные в пространстве. Поэтому происходит смешивание, усреднение, или, как говорят, гибридизация имеющихся орбиталей, и в результате получаются четыре новые одинаковые орбитали.
Эти орбитали-гибриды также похожи на восьмерки, но восьмерки однобокие: электронная плотность почти полностью смещена в одну сторону. Такие гибридизованные орбитали обозначаются sp3 (по числу электронов с разных не гибридных орбиталей, участвующих в их образовании: один с s-орбитали и три — с р-орбитали).
В молекуле метана атом углерода находится в центре правильного тетраэдра, а четыре атома водорода — по его вершинам.
Так выглядит молекула метана с учетом размеров атомов.
Чтобы построить модель молекулы, возьмем тетраэдр, т. е. правильный четырехгранник, составленный из равносторонних треугольников, и поместим в его центр атом углерода. Атомы водорода расположатся по вершинам тетраэдра. Соединим все водороды с центральным атомом углерода. Угол α между двумя такими линиями составит 109 градусов и 28 минут.
Итак, мы построили модель метана. Но каковы размеры молекул в действительности? В последние десятилетия при помощи физических методов исследования (о них речь впереди) удается точно определить межатомные расстояния в молекулах органических соединений. В молекуле метана расстояние между центрами атома углерода и любого водородного атома равно 0,109 нм (1 нанометр, нм, равен 10-9 м). Чтобы представить наглядно, как выглядит молекула в пространстве, пользуются моделями Стюарта — Бриглеба, в которых атомы изображаются шариками определенного радиуса.
Теперь зададимся таким вопросом: какие силы связывают атомы в молекуле органического соединения, почему атомы водорода не отрываются от углеродного центра?
Атом углерода состоит из положительно заряженного ядра (его заряд равен +6) и шести электронов, занимающих различные орбитали[1] вокруг ядра, каждой из которых соответствует определенный уровень энергии.
Два электрона занимают самую нижнюю, ближайшую к ядру орбиталь. Они всего сильнее взаимодействуют со "своим" ядром и участия в образовании химических связей не принимают. Иное дело — остальные четыре электрона. Считают, что в так называемом невозбужденном атоме углерода, т. е. в отдельном атоме, не образующем никаких связей с другими атомами, эти электроны располагаются следующим образом: два на нижнем подуровне s и два на более высоком подуровне р. Несколько упрощенно и схематично можно считать, что облако, которое образует электрон, находящийся на s-подуровне, имеет форму сферы. Облака р-электронов выглядят объемными восьмерками, причем эти восьмерки могут быть расположены в пространстве вдоль осей х, y и z. В соответствии с этим в каждом атоме имеются три р-орбитали: px, рy и pz. Итак, каждая орбиталь в атоме имеет определенную форму и особым образом расположена в пространстве.
Для того чтобы вступить во взаимодействие с другими атомами, образовать с ними химические связи, атом углерода должен прежде всего перейти в особое, возбужденное состояние. При этом один электрон перескакивает с s-орбитали на p-орбиталь. В результате один электрон занимает сферическую s-орбиталь, а три остальных электрона образуют три орбитали-восьмерки. Однако такое положение атому энергетически невыгодно. Более низкой энергии атома соответствуют четыре одинаковые орбитали, симметрично расположенные в пространстве. Поэтому происходит смешивание, усреднение, или, как говорят, гибридизация имеющихся орбиталей, и в результате получаются четыре новые одинаковые орбитали.
Эти орбитали-гибриды также похожи на восьмерки, но восьмерки однобокие: электронная плотность почти полностью смещена в одну сторону. Такие гибридизованные орбитали обозначаются sp3 (по числу электронов с разных не гибридных орбиталей, участвующих в их образовании: один с s-орбитали и три — с р-орбитали).
 Здесь схематично показана гибридизация орбиталей при образовании молекулы метана. Стрелками показано относительное направление спинов электронов
Как же устроена молекула метана? К каждой из четырех гибридных орбиталей, направленных от атома углерода в разные стороны (а точнее, в углы воображаемого тетраэдра, который можно построить вокруг него), подходят атомы водорода Н. Атом водорода- это ядро с зарядом +1 (для легкого изотопа обычного водорода — просто протон), и один электрон, занимающий сферическую орбиталь вокруг протона. Облака "углеродных" и "водородных" электронов перекрываются, а это и означает образование химической связи. Чем сильнее перекрываются облака электронов разных атомов, тем прочнее связь. Теперь становится понятным, почему гибридизованные орбитали выгоднее — ведь такая однобокая, выпяченная в одну сторону восьмерка может гораздо сильнее перекрываться с облаком водородного электрона, чем менее протяженные в пространстве не гибридные орбитали. Отметим, что эти рассуждения носят несколько условный характер: чистый, так сказать, одиночный и невозбужденный атом углерода не существует реально. Поэтому нет смысла обсуждать, как же в действительности происходят все эти трансформации орбиталей, называемые гибридизацией. Однако для удобства описания химических связей посредством формул и чисел такие условности оказываются полезными. Мы в этом еще не раз убедимся.
Как получить метан?
Один из простейших путей — подействовать водой на карбид алюминия:
Здесь схематично показана гибридизация орбиталей при образовании молекулы метана. Стрелками показано относительное направление спинов электронов
Как же устроена молекула метана? К каждой из четырех гибридных орбиталей, направленных от атома углерода в разные стороны (а точнее, в углы воображаемого тетраэдра, который можно построить вокруг него), подходят атомы водорода Н. Атом водорода- это ядро с зарядом +1 (для легкого изотопа обычного водорода — просто протон), и один электрон, занимающий сферическую орбиталь вокруг протона. Облака "углеродных" и "водородных" электронов перекрываются, а это и означает образование химической связи. Чем сильнее перекрываются облака электронов разных атомов, тем прочнее связь. Теперь становится понятным, почему гибридизованные орбитали выгоднее — ведь такая однобокая, выпяченная в одну сторону восьмерка может гораздо сильнее перекрываться с облаком водородного электрона, чем менее протяженные в пространстве не гибридные орбитали. Отметим, что эти рассуждения носят несколько условный характер: чистый, так сказать, одиночный и невозбужденный атом углерода не существует реально. Поэтому нет смысла обсуждать, как же в действительности происходят все эти трансформации орбиталей, называемые гибридизацией. Однако для удобства описания химических связей посредством формул и чисел такие условности оказываются полезными. Мы в этом еще не раз убедимся.
Как получить метан?
Один из простейших путей — подействовать водой на карбид алюминия:
 Однако карбид алюминия — слишком дорогое исходное вещество для получения такого обычного, такого дешевого продукта, как метан, и получать его из других соединений нет надобности — ведь природный газ на 85-98 % состоит из метана.
Метан — один из основных "кирпичиков", из которых можно строить органические соединения. Какие же это соединения и как их получить из метана?
Вообще-то метан — вещество сравнительно инертное, и набор химических реакций, которые можно с ним провести, невелик.
Возьмем смесь двух газов — метана и хлора и поместим ее в стеклянный сосуд. Если этот сосуд держать в темноте, то никакой реакции не наблюдается. Но попробуем осветить склянку солнечным светом ..
Квант света взаимодействует с молекулой хлора, в результате молекула расщепляется на две части — два атома хлора:
Однако карбид алюминия — слишком дорогое исходное вещество для получения такого обычного, такого дешевого продукта, как метан, и получать его из других соединений нет надобности — ведь природный газ на 85-98 % состоит из метана.
Метан — один из основных "кирпичиков", из которых можно строить органические соединения. Какие же это соединения и как их получить из метана?
Вообще-то метан — вещество сравнительно инертное, и набор химических реакций, которые можно с ним провести, невелик.
Возьмем смесь двух газов — метана и хлора и поместим ее в стеклянный сосуд. Если этот сосуд держать в темноте, то никакой реакции не наблюдается. Но попробуем осветить склянку солнечным светом ..
Квант света взаимодействует с молекулой хлора, в результате молекула расщепляется на две части — два атома хлора:
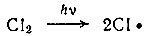 Получившиеся атомы гораздо активнее молекул, они тут же атакуют молекулы метана и захватывают атомы водорода. При этом образуются молекулы хлористого водорода НСl и весьма неустойчивые, очень активные частицы, так называемые метальные радикалы ⋅СН3:
Получившиеся атомы гораздо активнее молекул, они тут же атакуют молекулы метана и захватывают атомы водорода. При этом образуются молекулы хлористого водорода НСl и весьма неустойчивые, очень активные частицы, так называемые метальные радикалы ⋅СН3:
 Метальный радикал далее "расщепляет" молекулу хлора:
Метальный радикал далее "расщепляет" молекулу хлора:
 В результате получается уже известный нам атом хлора (его дальнейшую судьбу нетрудно предугадать: он атакует новые молекулы метана, и все повторяется) и хлорметан, или метилхлорид,- производное метана, в котором один из атомов водорода заменен на хлор.
Реакция, о которой мы рассказали, принадлежит к разряду так называемых цепных реакций, в которых каждая стадия, как в цепи, связана с предыдущей и с последующей. Активные частицы — продукт одной стадии (здесь это атомы хлора и метальные радикалы ⋅СН3) -используются в следующей стадии как исходные вещества. Открытие цепных реакций было одним из крупных событий в истории химической науки, а академик Н. Н. Семенов и английский ученый С. Н. Хиишельвуд за вклад в изучение таких реакций и создание их теории были удостоены Нобелевской премии.
Если в реакцию вводить такие количества реагентов, чтобы на одну молекулу хлора приходилось две молекулы метана, то в основном мы получим хлористый метил СН3Сl. Если же взять хлор в избытке, то реакция замещения пойдет дальше и получится, помимо хлористого метила, еще хлористый метилен СН2Сl2, хлороформ СНСl3 и, наконец, продукт полного замещения водорода на хлор, четыреххлористый углерод ССl4:
В результате получается уже известный нам атом хлора (его дальнейшую судьбу нетрудно предугадать: он атакует новые молекулы метана, и все повторяется) и хлорметан, или метилхлорид,- производное метана, в котором один из атомов водорода заменен на хлор.
Реакция, о которой мы рассказали, принадлежит к разряду так называемых цепных реакций, в которых каждая стадия, как в цепи, связана с предыдущей и с последующей. Активные частицы — продукт одной стадии (здесь это атомы хлора и метальные радикалы ⋅СН3) -используются в следующей стадии как исходные вещества. Открытие цепных реакций было одним из крупных событий в истории химической науки, а академик Н. Н. Семенов и английский ученый С. Н. Хиишельвуд за вклад в изучение таких реакций и создание их теории были удостоены Нобелевской премии.
Если в реакцию вводить такие количества реагентов, чтобы на одну молекулу хлора приходилось две молекулы метана, то в основном мы получим хлористый метил СН3Сl. Если же взять хлор в избытке, то реакция замещения пойдет дальше и получится, помимо хлористого метила, еще хлористый метилен СН2Сl2, хлороформ СНСl3 и, наконец, продукт полного замещения водорода на хлор, четыреххлористый углерод ССl4:
 Но не будем забывать о нашей задаче: построить различные сложные молекулы из простых кирпичиков-молекул метана. Для этого нам понадобится метилхлорид. Если подействовать на это соединение металлическим натрием, то из каждых двух молекул СН3Сl образуется одна молекула этана, в которой имеется связь углерод — углерод:
Но не будем забывать о нашей задаче: построить различные сложные молекулы из простых кирпичиков-молекул метана. Для этого нам понадобится метилхлорид. Если подействовать на это соединение металлическим натрием, то из каждых двух молекул СН3Сl образуется одна молекула этана, в которой имеется связь углерод — углерод:
 Что такое этан? Это метан, в котором один из водородов заменен на радикал метил ⋅СН3. А сам этот радикал, как мы уже знаем, получается при отрыве от метана одного водородного атома.
Если теперь в этане заместить один из водородов (любой атом) на метил, то мы получим новое вещество — пропан СН3-СН2-СН3. Как это можно сделать практически, мы знаем: сначала в метане и этане заместить один водород на хлор и затем подействовать на смесь метил- и этилхлорида натрием (эта реакция называется реакцией Вюрца в честь французского химика, ее открывшего):
Что такое этан? Это метан, в котором один из водородов заменен на радикал метил ⋅СН3. А сам этот радикал, как мы уже знаем, получается при отрыве от метана одного водородного атома.
Если теперь в этане заместить один из водородов (любой атом) на метил, то мы получим новое вещество — пропан СН3-СН2-СН3. Как это можно сделать практически, мы знаем: сначала в метане и этане заместить один водород на хлор и затем подействовать на смесь метил- и этилхлорида натрием (эта реакция называется реакцией Вюрца в честь французского химика, ее открывшего):
 Пойдем дальше. Заместим в пропане один из атомов водорода на хлор. Оказывается, теперь уже не все равно, какой атом замещать! Замещая водород при крайнем атоме углерода (таких атомов два) или же при среднем, мы получим два разных соединения: нормальный пропилхлорид (н-пропилхлорид) и изопропилхлорид:
Пойдем дальше. Заместим в пропане один из атомов водорода на хлор. Оказывается, теперь уже не все равно, какой атом замещать! Замещая водород при крайнем атоме углерода (таких атомов два) или же при среднем, мы получим два разных соединения: нормальный пропилхлорид (н-пропилхлорид) и изопропилхлорид:
 Заменим теперь в каждом из этих соединений атомы хлора на метальные группы. Мы получим два различных бутана — нормальный (т. е. не разветвленный) бутан (н-бутан) и изо-бутан:
Заменим теперь в каждом из этих соединений атомы хлора на метальные группы. Мы получим два различных бутана — нормальный (т. е. не разветвленный) бутан (н-бутан) и изо-бутан:

 Приставим к полученным молекулам еще по "кирпичику". Начнем с н-бутана. Здесь можно заместить на метил один из крайних атомов водорода. Получим нормальный пентан. Можно заместить один из средних водородов. Придем к изо-пентану. По-видимому, из н-бутана больше ничего нового не получишь. Обратимся к изо-бутану. Если в нем заместить один из крайних водородов (в СН3-группах), то придем к уже упоминавшемуся изо-пентану, а замещая средний единственный атом водорода, получим неопентан:
Приставим к полученным молекулам еще по "кирпичику". Начнем с н-бутана. Здесь можно заместить на метил один из крайних атомов водорода. Получим нормальный пентан. Можно заместить один из средних водородов. Придем к изо-пентану. По-видимому, из н-бутана больше ничего нового не получишь. Обратимся к изо-бутану. Если в нем заместить один из крайних водородов (в СН3-группах), то придем к уже упоминавшемуся изо-пентану, а замещая средний единственный атом водорода, получим неопентан:
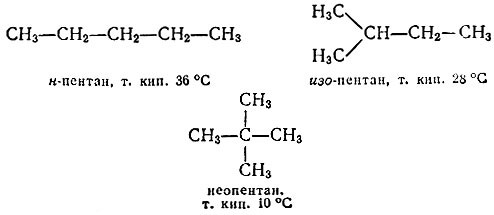 Продолжать эту процедуру можно до бесконечности. Все эти соединения называются углеводородами (точнее — предельными, насыщенными углеводородами, или алканами), потому что состоят они всего из двух элементов-углерода и водорода. В любом алкане число водородных атомов составляет 2n + 2, где n — число углеродных атомов. Поэтому формулу предельного углеводорода можно в общем виде записать так: СnН2n+2.
В построении наших структур мы, надо сказать, во-время остановились. Дело в том, что количество возможных изомеров катастрофически быстро возрастает с увеличением числа углеродных атомов в молекуле алкана. Так, для декана, углеводорода С10Н22, возможно 75 различных изомеров, число изомеров для углеводорода С20Н42 (эйкозан) равно 366 319. Количество же возможных изомеров для тетраконтана, углеводорода С40Н82, даже трудно себе представить: 62 491 178 805 831.
Теперь становится понятно, почему уже сегодня известно такое огромное число органических соединений — несколько миллионов — и почему в этом отношении химия органическая далеко обогнала химию неорганическую. А ведь до сих пор говорилось только о самых простых представителях органических веществ — о насыщенных углеводородах.
Мы выводили ряд изомерных углеводородов из метана, пользуясь реакцией Вюрца. Однако на практике так никто не поступает. Дело в том, что простейшие углеводороды наряду с метаном содержатся в природном газе, состав которого различен для разных месторождений. Например, в газе Северо-Ставропольского месторождения содержится 85 % метана, около 5% этана, 2,5% пропана и 1,4% пентана и более тяжелых углеводородов. Газ Газлинского месторождения состоит из метана на 98 %, этана в нем лишь 1,6 %. Много углеводородов в нефти, но об этом — в следующих главах.
Углеводороды низшие — метан, этан, пропан и бутан — бесцветные газы без запаха или со слабым запахом бензина. Углеводороды от пентана до пентадекана С15Н32 — жидкости и, наконец, высшие углеводороды при обычной температуре — твердые вещества.
Продолжать эту процедуру можно до бесконечности. Все эти соединения называются углеводородами (точнее — предельными, насыщенными углеводородами, или алканами), потому что состоят они всего из двух элементов-углерода и водорода. В любом алкане число водородных атомов составляет 2n + 2, где n — число углеродных атомов. Поэтому формулу предельного углеводорода можно в общем виде записать так: СnН2n+2.
В построении наших структур мы, надо сказать, во-время остановились. Дело в том, что количество возможных изомеров катастрофически быстро возрастает с увеличением числа углеродных атомов в молекуле алкана. Так, для декана, углеводорода С10Н22, возможно 75 различных изомеров, число изомеров для углеводорода С20Н42 (эйкозан) равно 366 319. Количество же возможных изомеров для тетраконтана, углеводорода С40Н82, даже трудно себе представить: 62 491 178 805 831.
Теперь становится понятно, почему уже сегодня известно такое огромное число органических соединений — несколько миллионов — и почему в этом отношении химия органическая далеко обогнала химию неорганическую. А ведь до сих пор говорилось только о самых простых представителях органических веществ — о насыщенных углеводородах.
Мы выводили ряд изомерных углеводородов из метана, пользуясь реакцией Вюрца. Однако на практике так никто не поступает. Дело в том, что простейшие углеводороды наряду с метаном содержатся в природном газе, состав которого различен для разных месторождений. Например, в газе Северо-Ставропольского месторождения содержится 85 % метана, около 5% этана, 2,5% пропана и 1,4% пентана и более тяжелых углеводородов. Газ Газлинского месторождения состоит из метана на 98 %, этана в нем лишь 1,6 %. Много углеводородов в нефти, но об этом — в следующих главах.
Углеводороды низшие — метан, этан, пропан и бутан — бесцветные газы без запаха или со слабым запахом бензина. Углеводороды от пентана до пентадекана С15Н32 — жидкости и, наконец, высшие углеводороды при обычной температуре — твердые вещества.
 Некоторые примеры использования метана
По мере увеличения числа атомов углерода растет температура кипения и плавления соединения.
У предельных углеводородов есть другое название — парафины, отражающее их химическую инертность (по латыни parum affinis — малое сродство). И все же они довольно широко применяются в химической промышленности для получения самых разнообразных веществ. Основные направления промышленного использования метана показаны на схеме.
Прежде чем закончить разговор о метане и предельных углеводородах, ответим на один вопрос: как осуществляется связь в парафинах между двумя атомами углерода, например, в этане? Здесь все просто — вокруг каждого углеродного атома имеются, как и в метане, четыре гибридизованные sр3-орбитали, три из них осуществляют связи с атомами водорода, а одна перекрывается точно с такой же орбиталью другого углеродного атома. Длина связи С-С составляет 0,154 нм.
Некоторые примеры использования метана
По мере увеличения числа атомов углерода растет температура кипения и плавления соединения.
У предельных углеводородов есть другое название — парафины, отражающее их химическую инертность (по латыни parum affinis — малое сродство). И все же они довольно широко применяются в химической промышленности для получения самых разнообразных веществ. Основные направления промышленного использования метана показаны на схеме.
Прежде чем закончить разговор о метане и предельных углеводородах, ответим на один вопрос: как осуществляется связь в парафинах между двумя атомами углерода, например, в этане? Здесь все просто — вокруг каждого углеродного атома имеются, как и в метане, четыре гибридизованные sр3-орбитали, три из них осуществляют связи с атомами водорода, а одна перекрывается точно с такой же орбиталью другого углеродного атома. Длина связи С-С составляет 0,154 нм.
Двойная связь
Этилен для органической химии — это уже, пожалуй, не кирпичик, а целый блок. Молекула этилена состоит из двух атомов углерода и четырех атомов водорода, Как же построен этилен? Ведь во всех органических соединениях углерод должен быть четырехвалентным, а в молекуле этилена каждый углеродный атом связан с другим углеродом и двумя водородами, т. е. как бы трехвалентен. Нет, никакого нарушения принципа четырехвалентности углерода в молекуле этилена не наблюдается: два атома углерода связаны между собой не простой, как в этане, а двойной связью. Каждая валентность обозначается чертой, и если соединить два атома углерода двумя черточками, то мы сохраним углерод четырехвалентным: Но что скрывается за такими обозначениями, чем отличается связь, изображаемая одной чертой, от связи, изображаемой двумя чертами?
Вспомним, как образуется молекула этана. Вокруг каждого углеродного атома в результате гибридизации, т. е. смешения, усреднения одной s- и трех р-орбиталей образуются четыре направленные в разные стороны совершенно одинаковые гибридизованные sр3-орбитали.
В случае этилена связи между атомами углерода строятся по-другому. Здесь смешиваются только две р-орбитали с одной орбиталью s. В результате образуются три гибридизованные sp2-орбитали, которые лежат в одной плоскости: две из них перекрываются с s-орбиталями двух атомов водорода и привязывают эти водороды к углероду, а третья орбиталь sp2 перекрывается с точно такой же орбиталью второго углеродного атома. На долю этой связи приходится одна из черточек между двумя атомами углерода. А что символизирует вторая черточка?
Вспомним: у нас остался еще один р-электрон. Он образует облако в виде объемной восьмерки, которая направлена перпендикулярно плоскости трех sp2-орбиталей. Эти-то электронные облака (по одной восьмерке от каждого углерода) тоже могут перекрываться между собой, только не "лоб в лоб", как перекрываются две sр2-орбитали, а "боками". Такое перекрывание и обозначает вторая черточка. Связь первого типа ("лбами") обозначается греческой буквой о (сигма), а связь, при которой электронные облака
Но что скрывается за такими обозначениями, чем отличается связь, изображаемая одной чертой, от связи, изображаемой двумя чертами?
Вспомним, как образуется молекула этана. Вокруг каждого углеродного атома в результате гибридизации, т. е. смешения, усреднения одной s- и трех р-орбиталей образуются четыре направленные в разные стороны совершенно одинаковые гибридизованные sр3-орбитали.
В случае этилена связи между атомами углерода строятся по-другому. Здесь смешиваются только две р-орбитали с одной орбиталью s. В результате образуются три гибридизованные sp2-орбитали, которые лежат в одной плоскости: две из них перекрываются с s-орбиталями двух атомов водорода и привязывают эти водороды к углероду, а третья орбиталь sp2 перекрывается с точно такой же орбиталью второго углеродного атома. На долю этой связи приходится одна из черточек между двумя атомами углерода. А что символизирует вторая черточка?
Вспомним: у нас остался еще один р-электрон. Он образует облако в виде объемной восьмерки, которая направлена перпендикулярно плоскости трех sp2-орбиталей. Эти-то электронные облака (по одной восьмерке от каждого углерода) тоже могут перекрываться между собой, только не "лоб в лоб", как перекрываются две sр2-орбитали, а "боками". Такое перекрывание и обозначает вторая черточка. Связь первого типа ("лбами") обозначается греческой буквой о (сигма), а связь, при которой электронные облака
 Схема образования двойной связи между двумя атомами углерода в молекуле этилена
перекрываются "боками", называется π-связью (а сами такие электроны — π-электронами). Все вместе это и есть двойная связь. Двойная связь короче простой, ее длина 0,133 нм.
Итак, мы разобрали устройство еще одной детали, из которых можно строить "здания" органических соединений. Какие же это здания?
Возьмем сначала такие сочетания: одна молекула этилена и несколько молекул метана. Если один атом водорода в молекуле этилена заменить на метильную группу (т. е. на остаток метана), то получим пропилен (называемый иначе пропеном) СН2=СН-СН3.
Теперь построим следующий член гомологического ряда (т. е. член, имеющий на одну группу СН2 больше). Для этого заместим один из атомов водорода в пропилене на метильную группу. Возможностей такого замещения несколько, в результате мы получим три различных бутилена (бутена).
Замещая водород метильной группы, придем к нормальному бутену-1: СН2=СН-СН2-СН3. Замещение водорода на другом конце даст бутен-2: СН3-СН=СН-СH3. Наконец, замещая единственный водород при двойной связи, получим изо-бутилен: СН2=С(СН3)2. Это три различных вещества, имеющих разные температуры кипения и плавления. Состав всех этих углеводородов отражается общей формулой СnН2n. Аналогично можно вывести формулы всех возможных пентенов, гексенов и т. д.
Итак, мы научились получать непредельные углеводороды на бумаге. Как же их получают в действительности?
Основной источник простейших алкенов (т. е. непредельных углеводородов)-нефтепродукты, из которых после нагревания и перегонки выделяют этилен, пропилен, бутилены... Если нагреть алкан (предельный углеводород) до 500-600 °С под большим давлением в присутствии катализатора, то два атома водорода отщепляются и образуется алкен. Из н-бутана, к примеру, получается смесь бутена-1 и бутена-2.
В лаборатории непредельные углеводороды (например, этилен) получают, отнимая воду от спиртов; для этого их нагревают с каталитическим количеством кислоты:
Схема образования двойной связи между двумя атомами углерода в молекуле этилена
перекрываются "боками", называется π-связью (а сами такие электроны — π-электронами). Все вместе это и есть двойная связь. Двойная связь короче простой, ее длина 0,133 нм.
Итак, мы разобрали устройство еще одной детали, из которых можно строить "здания" органических соединений. Какие же это здания?
Возьмем сначала такие сочетания: одна молекула этилена и несколько молекул метана. Если один атом водорода в молекуле этилена заменить на метильную группу (т. е. на остаток метана), то получим пропилен (называемый иначе пропеном) СН2=СН-СН3.
Теперь построим следующий член гомологического ряда (т. е. член, имеющий на одну группу СН2 больше). Для этого заместим один из атомов водорода в пропилене на метильную группу. Возможностей такого замещения несколько, в результате мы получим три различных бутилена (бутена).
Замещая водород метильной группы, придем к нормальному бутену-1: СН2=СН-СН2-СН3. Замещение водорода на другом конце даст бутен-2: СН3-СН=СН-СH3. Наконец, замещая единственный водород при двойной связи, получим изо-бутилен: СН2=С(СН3)2. Это три различных вещества, имеющих разные температуры кипения и плавления. Состав всех этих углеводородов отражается общей формулой СnН2n. Аналогично можно вывести формулы всех возможных пентенов, гексенов и т. д.
Итак, мы научились получать непредельные углеводороды на бумаге. Как же их получают в действительности?
Основной источник простейших алкенов (т. е. непредельных углеводородов)-нефтепродукты, из которых после нагревания и перегонки выделяют этилен, пропилен, бутилены... Если нагреть алкан (предельный углеводород) до 500-600 °С под большим давлением в присутствии катализатора, то два атома водорода отщепляются и образуется алкен. Из н-бутана, к примеру, получается смесь бутена-1 и бутена-2.
В лаборатории непредельные углеводороды (например, этилен) получают, отнимая воду от спиртов; для этого их нагревают с каталитическим количеством кислоты:
 Можно также отщеплять молекулу галогеноводорода щелочью от галогенопроизводных предельных углеводородов:
Можно также отщеплять молекулу галогеноводорода щелочью от галогенопроизводных предельных углеводородов:
 Спектр реакций, в которые вступают соединения с двойной связью, гораздо разнообразнее, шире, нежели набор превращений алканов. Рассмотрим одну из таких реакций ненасыщенных соединений.
Непредельные вещества присоединяют галогеноводороды по двойной связи, при этом образуются галогенозамещенные предельные углеводороды (т. е. идет реакция, обратная только что написанной). Но если присоединять галогеноводород к несимметричному алкену (к такому, у которого по обе стороны от двойной связи находятся различные группы), то могут получиться два разных производных, например, в случае пропена, либо СН3СН2СН2Сl, либо СН3СНClСН3.
Эту реакцию еще в прошлом веке изучал русский химик В. В. Марковников. Он установил правило, которое теперь носит его имя: галоген присоединяется к наименее гидрогенизованному атому углерода (т. е, такому, который связан с наименьшим числом атомов водорода). Значит, из пропилена образуется в основном хлористый изо-пропил СН3СНClСН3. Но почему реакция идет именно так? Современная теория дает объяснение правила Марковникова. Мы изложим эту теорию в несколько упрощенном виде.
Дело в том, что механизмы даже простых на первый взгляд химических реакций довольно сложны, включают несколько стадий. Так и с реакцией присоединения галогеноводорода. Молекула хлористого водорода присоединяется к молекуле алкена не сразу, а по частям. Первым присоединяется водород в виде протона Н+. Положительно заряженный протон подходит к молекуле пропилена. Какой из атомов углерода, соединенных двойной связью, он будет атаковать? Оказывается — крайний, потому что на нем находится небольшой отрицательный заряд, обозначаемый δ- (дельта минус). Но как возник этот заряд, небольшой избыток электронной плотности?
В этом "повинна" метальная группа. Она как бы отталкивает от себя электроны, которые поэтому накапливаются у противоположного атома углерода, подальше от метильной группы. Только еще раз подчеркнем, что это смещение электронной плотности очень мало. Оно гораздо меньше, чем если бы целый электрон переселился от среднего атома углерода к крайнему. Тогда бы мы должны были поставить над средним атомом плюс, а над крайним минус (мы же ставим знак δ-, что означает малую часть от полного отрицательного заряда электрона).
Итак, теперь ясно, что положительно заряженный протон гораздо охотнее подойдет к крайнему атому углерода, несущему некоторый избыток электронной плотности.
Спектр реакций, в которые вступают соединения с двойной связью, гораздо разнообразнее, шире, нежели набор превращений алканов. Рассмотрим одну из таких реакций ненасыщенных соединений.
Непредельные вещества присоединяют галогеноводороды по двойной связи, при этом образуются галогенозамещенные предельные углеводороды (т. е. идет реакция, обратная только что написанной). Но если присоединять галогеноводород к несимметричному алкену (к такому, у которого по обе стороны от двойной связи находятся различные группы), то могут получиться два разных производных, например, в случае пропена, либо СН3СН2СН2Сl, либо СН3СНClСН3.
Эту реакцию еще в прошлом веке изучал русский химик В. В. Марковников. Он установил правило, которое теперь носит его имя: галоген присоединяется к наименее гидрогенизованному атому углерода (т. е, такому, который связан с наименьшим числом атомов водорода). Значит, из пропилена образуется в основном хлористый изо-пропил СН3СНClСН3. Но почему реакция идет именно так? Современная теория дает объяснение правила Марковникова. Мы изложим эту теорию в несколько упрощенном виде.
Дело в том, что механизмы даже простых на первый взгляд химических реакций довольно сложны, включают несколько стадий. Так и с реакцией присоединения галогеноводорода. Молекула хлористого водорода присоединяется к молекуле алкена не сразу, а по частям. Первым присоединяется водород в виде протона Н+. Положительно заряженный протон подходит к молекуле пропилена. Какой из атомов углерода, соединенных двойной связью, он будет атаковать? Оказывается — крайний, потому что на нем находится небольшой отрицательный заряд, обозначаемый δ- (дельта минус). Но как возник этот заряд, небольшой избыток электронной плотности?
В этом "повинна" метальная группа. Она как бы отталкивает от себя электроны, которые поэтому накапливаются у противоположного атома углерода, подальше от метильной группы. Только еще раз подчеркнем, что это смещение электронной плотности очень мало. Оно гораздо меньше, чем если бы целый электрон переселился от среднего атома углерода к крайнему. Тогда бы мы должны были поставить над средним атомом плюс, а над крайним минус (мы же ставим знак δ-, что означает малую часть от полного отрицательного заряда электрона).
Итак, теперь ясно, что положительно заряженный протон гораздо охотнее подойдет к крайнему атому углерода, несущему некоторый избыток электронной плотности.
 Положительно заряженный протон присоединился к незаряженной молекуле и передал ей свой заряд. Где этот заряд расположится? Если бы протон присоединился к среднему атому углерода, то заряд возник бы на крайнем углероде. На самом деле протон подходит к крайнему атому углерода, и заряд возникает на среднем углероде.. А есть ли разница, где сосредоточен заряд? Да, и разница большая. Оба карбокатиона (т. е. органические частицы, несущие положительный заряд на атоме углерода) неустойчивы, живут очень недолго. Но все же второй катион устойчивее: дело в том, что он с двух сторон окружен метальными группами; а мы уже знаем, что метальные группы способны подавать электроны, отталкивать их от себя. Получается, что метальные группы частично компенсируют возникающий положительный заряд, А чем меньше этот заряд, тем карбокатион устойчивее. В первом случае положительный заряд . погашается лишь одной этильной группой, этот карбокатион будет менее устойчив, чем второй.
Как правило, чем устойчивее какая-нибудь частица, тем она легче образуется. А это значит, что второй карбокатион будет получаться гораздо чаще первого. Вторая стадия реакции — присоединение отрицательно заряженного иона хлора к карбокатиону. Поскольку в продуктах первой стадии преобладает карбокатион второго типа, то в результате всей реакции на одну молекулу 1-хлорпропана приходятся тысячи молекул изомера, в котором хлор присоединен к среднему углероду. Поэтому мы и говорим, что присоединение идет в основном по правилу Марковникова. Два фактора — место атаки протона на первой стадии и устойчивость образующегося после этого карбокатиона — обусловливают выполнение этого правила.
Положительно заряженный протон присоединился к незаряженной молекуле и передал ей свой заряд. Где этот заряд расположится? Если бы протон присоединился к среднему атому углерода, то заряд возник бы на крайнем углероде. На самом деле протон подходит к крайнему атому углерода, и заряд возникает на среднем углероде.. А есть ли разница, где сосредоточен заряд? Да, и разница большая. Оба карбокатиона (т. е. органические частицы, несущие положительный заряд на атоме углерода) неустойчивы, живут очень недолго. Но все же второй катион устойчивее: дело в том, что он с двух сторон окружен метальными группами; а мы уже знаем, что метальные группы способны подавать электроны, отталкивать их от себя. Получается, что метальные группы частично компенсируют возникающий положительный заряд, А чем меньше этот заряд, тем карбокатион устойчивее. В первом случае положительный заряд . погашается лишь одной этильной группой, этот карбокатион будет менее устойчив, чем второй.
Как правило, чем устойчивее какая-нибудь частица, тем она легче образуется. А это значит, что второй карбокатион будет получаться гораздо чаще первого. Вторая стадия реакции — присоединение отрицательно заряженного иона хлора к карбокатиону. Поскольку в продуктах первой стадии преобладает карбокатион второго типа, то в результате всей реакции на одну молекулу 1-хлорпропана приходятся тысячи молекул изомера, в котором хлор присоединен к среднему углероду. Поэтому мы и говорим, что присоединение идет в основном по правилу Марковникова. Два фактора — место атаки протона на первой стадии и устойчивость образующегося после этого карбокатиона — обусловливают выполнение этого правила.
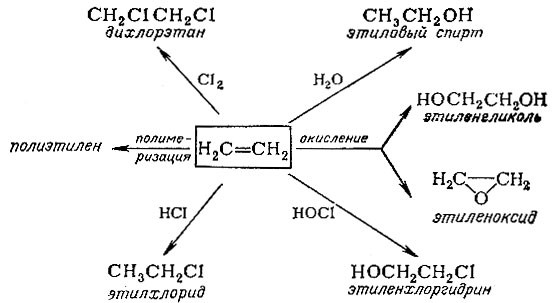 Некоторые примеры использования этилена
Непредельные соединения легко присоединяют не только хлористый водород, но и многие другие молекулы. Характерные примеры химических превращений этилена приведены на схеме.
У читателя может возникнуть вопрос: существуют ли органические молекулы, построенные только из этиленовых блоков? Да, существуют. И простейший представитель — бутадиен СН2=СН-СН=СН2. Это соединение широко используется в производстве синтетического каучука. В помидорах, фруктах обнаружен углеводород ликопин — кристаллы красного цвета. В углеродной цепочке этого вещества 13 двойных связей.
Некоторые примеры использования этилена
Непредельные соединения легко присоединяют не только хлористый водород, но и многие другие молекулы. Характерные примеры химических превращений этилена приведены на схеме.
У читателя может возникнуть вопрос: существуют ли органические молекулы, построенные только из этиленовых блоков? Да, существуют. И простейший представитель — бутадиен СН2=СН-СН=СН2. Это соединение широко используется в производстве синтетического каучука. В помидорах, фруктах обнаружен углеводород ликопин — кристаллы красного цвета. В углеродной цепочке этого вещества 13 двойных связей.
Тройная связь
Молекула ацетилена состоит из двух атомов углерода и двух атомов водорода. Связь между двумя углеродами обозначается тремя черточками. Как же устроена тройная связь? ...Все права на текст принадлежат автору: Георгий Борисович Шульпин.
Это короткий фрагмент для ознакомления с книгой.

 Скачать или читать эту книгу на КулЛиб
Скачать или читать эту книгу на КулЛиб